Wasser - ein großes Rätsel
Was soll an diesem Stoff schon Besonderes sein? Wasser ist farblos, riecht und schmeckt nach nichts. Es fällt vom Himmel und fließt aus dem Küchenhahn. Und auch von Geburt her zeichnet die Substanz nichts aus: Sie entsteht aus dem häufigsten und dem dritthäufigsten Element des Universums, nämlich Wasserstoff und Sauerstoff, im Verhältnis 2:1. Es ist eins der kleinsten und leichtesten Moleküle, die wir kennen. Seit mehreren hundert Jahren studieren Forscher die chemische Verbindung mit der schlichten Formel H2O.
Wasser - ein großes Rätsel
Da überrascht es schon, wenn Felix Franks sagt: "Wasser stellt Physiker und Biochemiker immer noch vor eine Reihe großer Rätsel." Ungeklärt sind so fundamentale Fragen wie: Auf welche Weise genau ordnen sich die Moleküle in dem Getränk, das unseren Durst löscht? Warum verhält sich der Stoff, mit dem wir uns waschen, in dem wir schwimmen, in vielerlei Hinsicht so anomal? Weshalb zeigt Wasser in kristalliner Form, als Eis also, derart viele Gesichter?
Je mehr die Forscher im Lauf der Zeit über das Wasser herausfanden, desto deutlicher wurde, dass H2O sich in flüssiger Form grotesk atypisch verhält. "Wasser zeigt eine ungeheure Vielfalt von Effekten, die es bei keiner anderen Flüssigkeit gibt", sagt Alfons Geiger, ein führender Wasserforscher von der Universität Dortmund. Seit 25 Jahren ist der Physikochemiker eingetaucht in die nasse Materie und dabei ist für ihn "immer klarer geworden, dass die Flüssigkeitswelt zweigeteilt ist. Auf der einen Seite steht das Wasser, auf der anderen stehen all die anderen Substanzen". Rund 40 Anomalien listen Wissenschaftler für Wasser auf.
H2O hat einen exzentrischen Charakter
Zum Verständnis des exzentrischen Charakters von Wasser hilft es, sich den Bau der Teilchen und deren Kontaktaufnahme untereinander genau anzusehen. Demnach gleicht H2O auf den ersten Blick einem V: in der Mitte ein Sauerstoffatom, am Ende der beiden Arme jeweils ein Wasserstoffatom. Das ist aber nur die halbe Wahrheit: Am zentralen Sauerstoff ragen zusätzlich zwei diffuse Wolken in den Raum, in denen jeweils zwei negativ geladene Elektronen herumsausen. Die Sonderstellung des Wassers beruht aber auf einer speziellen Klebrigkeit der H2O-Partikel. Auf dem, was Chemiker eine "Wasserstoffbrücke" nennen. Und diese Wasserstoffbrücke funktioniert so: Der Sauerstoff reißt die Elektronen an sich. Dadurch lädt sich der Wasserstoff positiv auf. Da sich entgegengesetzte elektrische Ladungen wie Süd- und Nordpol von Magneten anziehen, heften sich Wasserstoffatome eines Moleküls an "freie Elektronenpaare" benachbarter Teilchen.
Der Wasserstoffbrücken-Kleber
Der besondere Wasserstoffbrücken-Kleber erklärt, weshalb H2O im Vergleich zu chemisch verwandten Stoffen einen ungewöhnlich hohen Siedepunkt - und Schmelzpunkt - aufweist. Und weshalb die Substanz so viel Wärme speichern kann: Eine Menge Energie fließt in die Wasserstoffbrücken und bricht sie auf. Beim Abkühlen schnappen die Bindungen wieder zu, die Wärme wird wieder frei. Eine Erklärung für die anormale Viskosität, die Abnahme der Zähigkeit bei höherem Druck, fanden Alfons Geiger und seine Kollegen, als sie in einer Computersimulation das Brückennetzwerk unter die Lupe nahmen. Dabei stellten sie fest, "dass Wassermoleküle, die genau vier Nachbarn haben sich sehr langsam bewegen, weil sie fest eingebunden sind".
"Zwar sind die großen Züge des Bildes konsistent", schränkt Geiger ein, "aber im Detail ist noch Arbeit zu leisten." So wurmt es Chemiker und Physiker, dass sie die Exzentrizität des Wassers nicht präzise berechnen können. Vielleicht liegt das ja daran, dass sie von der grundlegenden Struktur des H2O eine falsche Vorstellung haben. Wir haben uns an detailscharfe Bilder aus der Mikrowelt gewöhnt, warum gelingen solche Darstellungen nicht auch beim vertrauten Wasser? Weil es in der flüssigen Form so ungeheuer dynamisch ist und die Einzelmoleküle quecksilbrig flink ihre Position und ihre Brücken zu Nachbarn ändern. Und weil die leichten Wasserstoffatome so schwer zu "fotografieren" sind.
Eine Kontroverse über die Anordnung der Moleküle in der Flüssigkeit
Eine heftige Kontroverse entbrannte 2004 darüber, wie sich die Moleküle in der Flüssigkeit anordnen. Ob sie jeweils, so das traditionelle Bild, im Durchschnitt 3,5 Wasserstoffbrücken bilden - 3,5 deshalb, weil das perfekte Vierernetz im flüssigen Zustand teilweise gerissen ist. Oder ob sie nur zwei perfekte Wasserstoffbrücken aufbauen, während die anderen deutlich schwächer oder gar gebrochen sind. Wenn das so wäre, lägen die H2O-Teilchen in Ketten und Ringen vor, mit einer Wasserstoffbrücke auf der Sauerstoff- und einer auf der Wasserstoffseite. Und nicht in dem bislang favorisierten Netzwerk. Bis die Kontroverse um die Grundstruktur des H2O beigelegt ist, wird es wohl noch einige Zeit dauern. Eines freilich lässt sich daraus lernen: wie widerwillig der alltägliche Stoff seine Geheimnisse preisgibt.

Geschöpfe aus Wasser
Auch wir sind Geschöpfe aus Wasser: Der menschliche Organismus besteht zu fast zwei Dritteln aus der merkwürdigen Substanz, das Gehirn zu 77, Muskulatur sogar zu fast 80 Prozent. Aber warum schwabbeln wir nicht wie eine prall gefüllte Wärmflasche? "Wir müssen es uns eher wie Gelatine vorstellen," stellt der Chemiker Roland Winter klar, der in Dortmund am selben Institut wie Alfons Geiger die Bedeutung von H2O für die Funktion von Biomolekülen erforscht. Ein Wackelpudding also, gewürzt mit Unmengen von Eiweißen, Salzen, Aminosäuren, Zuckern, Fetten; und mit der Erbsubstanz DNS. Das H2O steckt dabei in den schmalen Lücken zwischen voluminösen chemischen Strukturen. Und in solche begrenzten Räume gezwungen, kann es seine Eigenschaften verändern: Es "gefriert" anders, es entwickelt merkwürdige Anziehungs- und Abstoßungskräfte. Was in dieser engen Welt im Detail abläuft, ist in vielen Fällen noch rätselhaft.
Quell des Lebens
Wasser – das zwiespältige Element. In seiner flüssigen Form gilt es als Quell des Lebens, als Elixier des Organischen; im kristallinen Zustand stoppt es die vitalen Vorgänge, im Eis erstarrt fast alles. Die ersten Expeditionen ins Eisland unternahmen zu Beginn des 20. Jahrhunderts der in Göttingen lehrende Gustav Tammann und vor allem der amerikanische Physiker und spätere Nobelpreisträger Percy Bridgman. Sie entdeckten, dass Eis unterschiedliche Architekturen aufweist. Derzeit sind, wie erwähnt, 15 kristalline Typen bekannt. Erst Ende März 2006 berichtete Christoph Salzmann von der Universität Oxford über die Entdeckung der beiden vorläufig letzten Varianten. Das so genannte Phasendiagramm, in dem die Forscher die Existenzbereiche der verschiedenen Varianten eintragen, sieht deshalb aus wie ein Flickenteppich. Und die Aussichten, künftig weitere "Kleinstaaten" zu entdecken, stehen gut.
Der wilde Tanz der Wassermoleküle
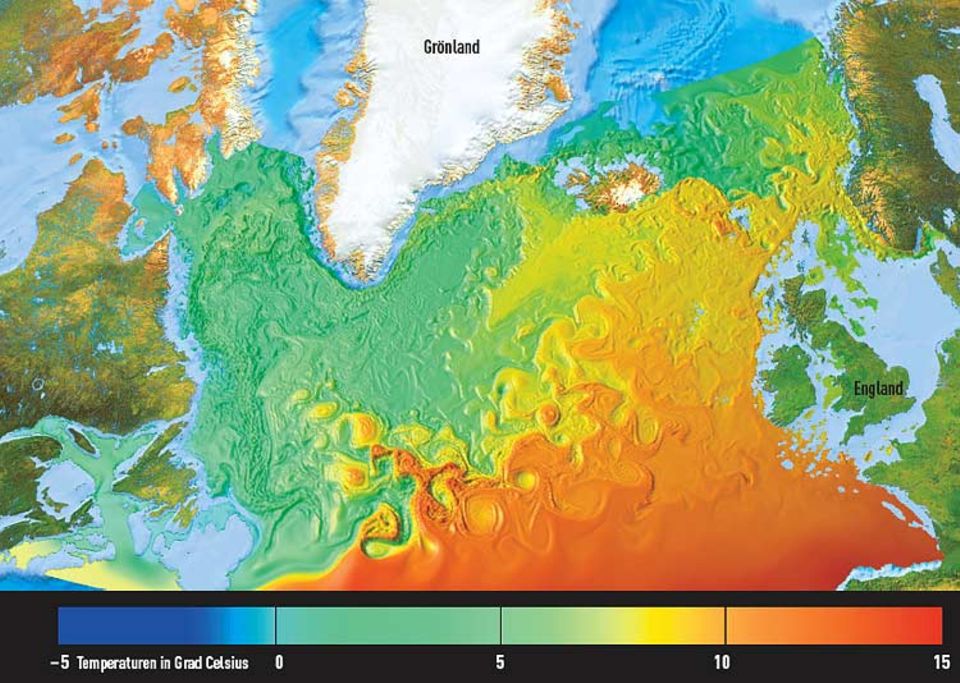
An die Erforschung der kalten Regionen knüpfen sich freilich nicht nur Hoffnungen auf puren Erkenntnisgewinn. Neue Ergebnisse könnten auch der Kryobiologie zugute kommen, also etwa die Kältekonservierung biologischen Gewebes verbessern helfen. Einer, der den eisigen Kontinent erforscht, ist Thomas Loerting vom Institut für Allgemeine, Anorganische und Theoretische Chemie der Universität Innsbruck. "Selbst bei Normaldruck existieren zwei Eisformen", erklärt Loerting: so genanntes hexagonales und kubisches Eis, bezeichnet als Eis Ih und Ic. Sie unterschieden sich in ihrer Stabilität. "Es ist nur ein Hauch von Nichts, trotzdem gibt es auf der Erde fast ausschließlich hexagonales Eis." Aus ihm bestehen Schneeflocken, die Eiswürfel im Whiskyglas, der Frostdeckel auf Seen und eichen. Der anderen Variante liegt ein kubisches Muster zugrunde - solche Eiskristalle sind würfelförmig. Sie kommen allerdings nur unter außergewöhnlichen Bedingungen vor, etwa in den großen, tödlich kalten Höhen der Erdatmosphäre. Eines haben beide Varianten gemeinsam: Sie sind recht voluminös.
Der Grund liegt einmal mehr in den Wasserstoffbrücken. Wenn der wilde Tanz, den die Wassermoleküle im flüssigen Zustand aufführen, im Eis erstarrt, ordnen sie sich zu einem regelmäßigen Gittergeflecht. Zunächst biegen und krümmen sich die Wasserstoffbrücken, das dreidimensionale Netz orientiert sich zu zwei Geflechten um, von denen das eine den "vergeudeten" Raum des anderen füllt.
Fensterglas hat den Grundstein für das irdische Leben gelegt
Wird die Substanz noch weiter zusammengepresst, kollabiert das auf Abstand bedachte System, die Atome rücken so eng zusammen, dass Wasserstoffbrücken von "normalen" Bindungen nicht mehr zu unterscheiden sind. Es ist schon schwer genug, den Überblick über die diversen kristallinen Sorten zu behalten. Aber Wasser vermag obendrein mehrere glasartige oder amorphe Formen zu bilden. "99,9 Prozent des Eises im Weltall liegen amorph vor," sagt Thomas Loerting. Was unterscheidet nun kristalline und amorphe Arten? Es ist ihr inneres Gefüge: Während die Wassermoleküle sich im Kristall regelmäßig anordnen, in alle Richtungen im immer gleichen Abstand sitzen, liegen sie im amorphen Zustand so durcheinander wie in der Flüssigkeit, als sei diese von einem auf den anderen Moment erstarrt. Der bekannteste Vertreter dieser Materieform ist gewöhnliches Fensterglas. So exotisch das Glas-Eis anmutet: Es könnte nach Ansicht der amerikanischen Astrobiologen David Blake und Peter Jenniskens den Grundstein für das irdische Leben gelegt haben. In seiner flexiblen Struktur, argumentieren die beiden, vermochten sich Elemente wie Stickstoff, Sauerstoff und Kohlenstoff zu lösen und miteinander zu einfachen Biomolekülen zu reagieren. Mit Kometen seien diese organischen Bausteine in der Frühzeit des onnensystems auf unserem Planeten gelandet
Ordnung wird zu Chaos
Auf der Erde bildet sich das universale Glas-Wasser heute, wenn Forscher die Temperatur binnen Sekundenbruchteilen um Hunderte Grad Celsius senken. Und es entsteht in der Hochdruckpresse im Innsbrucker Labor. Michael Elsässer, ein junger Chemiker aus Loertings Team, präpariert für das Experiment einen Zylinder aus speziell gehärtetem Stahl. In die acht Millimeter starke Bohrung in der Mitte bugsiert er zunächst einen kleinen Container aus Indium, einem auch bei tiefen Temperaturen noch formbaren Metall. Das Ganze kommt in einen Kochtopf, der zwecks Isolierung mit Schaumstoff umwickelt ist, und der Topf wiederum in die Hochdruckpresse. Sie dient gewöhnlich Materialprüfern dazu, die Belastbarkeit von Werkstoffen zu testen, hier in Innsbruck setzt sie Wassertropfen unter Tonnenlast. In den vorgekühlten Indiumbehälter füllt Elsässer eine Winzigkeit Wasser. Ist dies geschafft, wird ein Metallstift eingesetzt, dann flüssiger Stickstoff, minus 196 Grad Celsius kalt, in den Kochtopf gegossen. Das Kältemittel zischt und brodelt, die Temperatur sinkt rapide. Das Wasser ist längst gefroren.
Ordnung wird zu Chaos
Computergesteuert senkt sich die Presse. Die Druckwerte auf dem Monitor rasen nach oben, eine Kurve zeigt an, wie das Eis schrumpft. Es knackt verdächtig im Stahlzylinder. Nach sechs Minuten ist der Druck auf 90.000 Atmosphären gestiegen. "Wir sehen hier etwas ganz Ungewöhnliches: Aus einem kristallinen Stoff entsteht eine amorphe Substanz", erklärt Loerting. Ordnung wird zu Chaos, aus Eis I wird so genanntes amorphes Eis hoher Dichte, abgekürzt HDA (high density amorphous ice). Nach beendeter Metamorphose fährt die Presse langsam zurück und gibt den Stahlzylinder frei. Rein äußerlich ist der weiße Feststoff, der aus dem Behälter hervorlugt, nicht von gewöhnlichem Eis zu unterscheiden. Würde man den Brocken jedoch in flüssiges Wasser werfen, ginge er unter, da er schwerer ist.
Popcorn-Eis
Beim Erwärmen macht das HDA seinem Spitznamen Popcorn-Eis Ehre. Wie ein Maiskorn in der heißen Pfanne platzt der Indiumbehälter auf, und flaumige Substanz quillt heraus: Der unermüdliche Verwandlungskünstler H2O hat sich schon wieder einen neuen Charakter zugelegt, das HDA hat sich in eine weitere Variante glasartigen Eises umgeordnet, die wegen ihrer geringeren Dichte LDA (low density amorphous ice) genannt wird. Als Loerting und Kollegen HDA unter Druck hielten und von minus 196 auf minus 105 Grad Celsius erwärmten, zog sich die Probe zusammen. Das widersprach jeglicher Erfahrung, nach der Substanzen sich bei steigenden Temperaturen ausdehnen. Die Erklärung der Innsbrucker Forscher: Sie hatten eine dritte Glas-Variantemit sehr hoher Dichte entdeckt - VHDA (very high density amorphous ice). Wieso sich in "Eisland" drei - oder noch mehr? - amorphe Enklaven eingenistet haben, warum sie gerade an diesen Stellen liegen, in welchen Beziehungen sie untereinander stehen - diese Fragen sind ungeklärt und Gegenstand heftiger Diskussionen. Den forschenden "Wasserköpfen" gehen die Probleme also nicht aus. Dem Laien bleibt das Staunen, dass ausgerechnet dieser durchsichtige Stoff so schwer zu durchschauen ist.



























