Es mag zunächst beunruhigend klingen: So gut wie jeder Mensch trägt abnorme, potenzielle Krebszellen in sich. Umweltgifte, ungesunde Lebensgewohnheiten wie Alkoholkonsum oder Rauchen, Krankheitserreger oder schlicht Erbgutschäden, die sich mit dem Alter anhäufen, lassen früher oder später Zellen entarten. Angesichts des Schreckens, den die Krankheit Krebs verbreitet, eine womöglich entmutigende Erkenntnis. Tatsächlich birgt sie aber auch einen Grund zur Hoffnung und einen überaus mächtigen Ansatzpunkt für die moderne Krebsforschung.
Denn trotz der Allgegenwart entarteter Zellen erkrankt beispielsweise in Deutschland nicht mal jeder zweite Mensch im Laufe unseres immer länger werdenden Lebens an Krebs. Bis zum 65 Lebensjahr bleiben sogar fünf von sechs Frauen und sechs von sieben Männern tumorfrei. Der Grund liegt darin, dass unser Körper gegenüber den Irrläuferzellen keineswegs wehrlos ist. Im Gegenteil: Die allermeisten Krebsvorstufen vernichtet er ohne viel Aufhebens, bevor sie Schaden anrichten. Wir sind uns dessen nur nicht bewusst, weil wir davon nichts mitbekommen.
Mutationen helfen Krebszellen, das Immunsystem auszutricksen
So gehen viele potenzielle Krebszellen bereits in einem frühen Stadium durch zelleigene Kontrollmechanismen zugrunde. Darüber hinaus patrouillieren ständig Immunzellen durch unseren Körper, die auffälliges Gewebe mit erstaunlicher Präzision aufspüren und vernichten. Kein Wunder, schließlich ist Krebs evolutionär gesehen ein alter Bekannter. Seit es Mehrzeller gibt, gibt es Krebs. Das Leben hatte Jahrmillionen Zeit, immer raffiniertere Abwehrmaßnahmen gegen die gefährlichen Wucherungen zu entwickeln.
Wahr ist aber auch: Wenn genügend ungünstige Mutationen in einer Zelle, sprich Veränderungen im Erbgut, zusammenkommen, dann kann sich daraus Krebs entwickeln. Mutationen können Zellen neue Fähigkeiten verleihen; zum Beispiel sich unsichtbar zu machen, das Immunsystem mit Botenstoffen zu schwächen oder sich ungehemmt zu teilen.
Mit revolutionären Methoden machen Forschende das Immunsystem fit gegen Krebs
Weil unsere Körperabwehr im Kampf gegen Krebszellen manchmal versagt, bleibt die Krankheit eine echte Gefahr. Doch dank medizinischer Fortschritte wendet sich das Blatt allmählich. Chirurgie, Strahlen-, Chemo- und Hormontherapie haben unzählige Siege gegen den Krebs errungen. "Als Werkzeuge gegen alle Formen von Tumoren greifen sie aber nicht", sagt Professor Niels Halama, medizinischer Onkologe und Leiter der Abteilung für Tumorimmunologie und Tumorimmuntherapie am Deutschen Krebsforschungszentrum.
Daher richten sich große Hoffnungen auf neuartige, zielgerichtete Immuntherapien. Wissenschaftlerinnen und Wissenschaftler weltweit haben in den vergangenen Jahren Methoden entwickelt, mit denen sie körpereigene Immunzellen bei ihrer Arbeit unterstützen können. Das Ziel vieler Ansätze: Immunzellen so aufzurüsten, dass sie Krebszellen noch besser erkennen und bekämpfen.

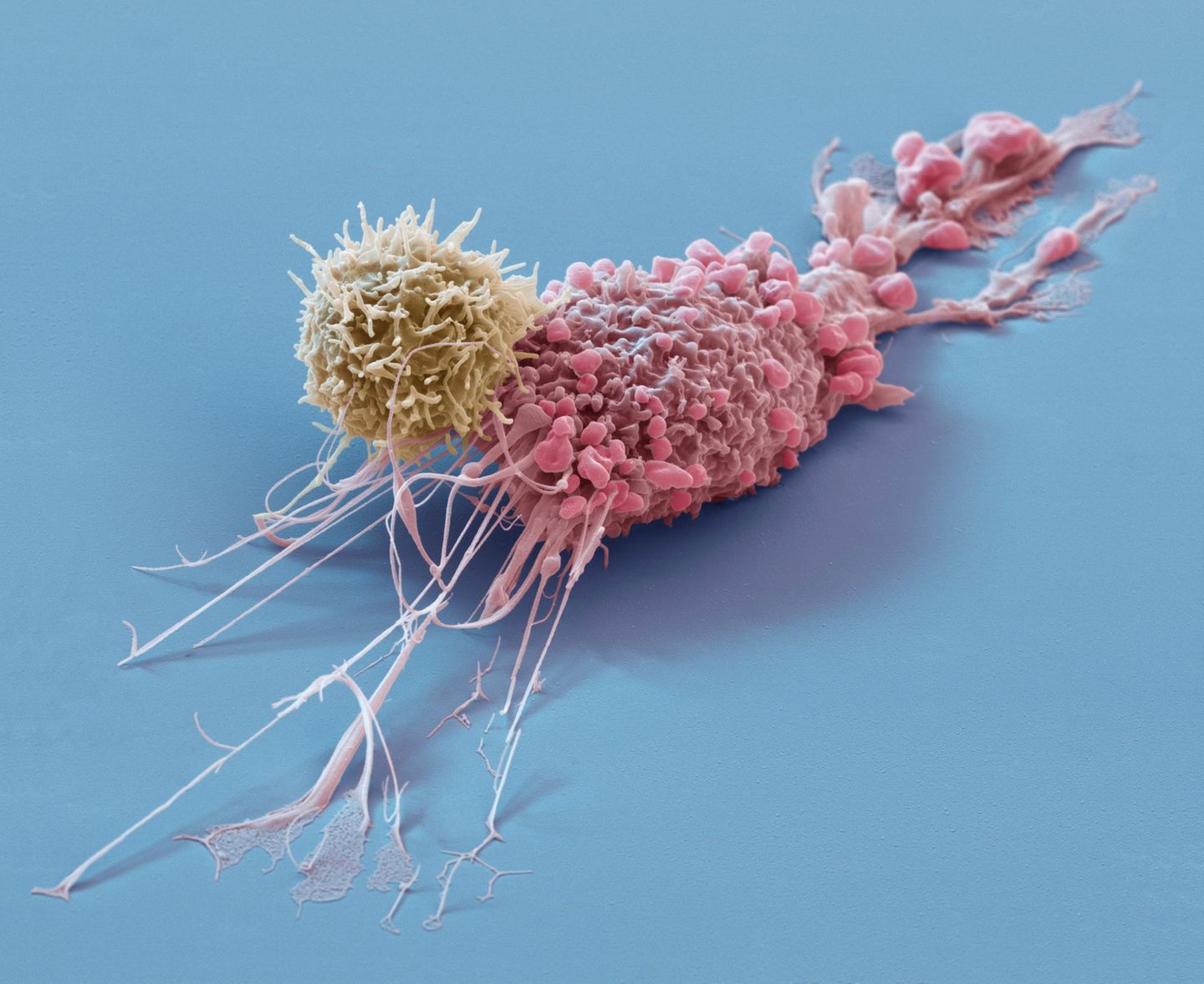
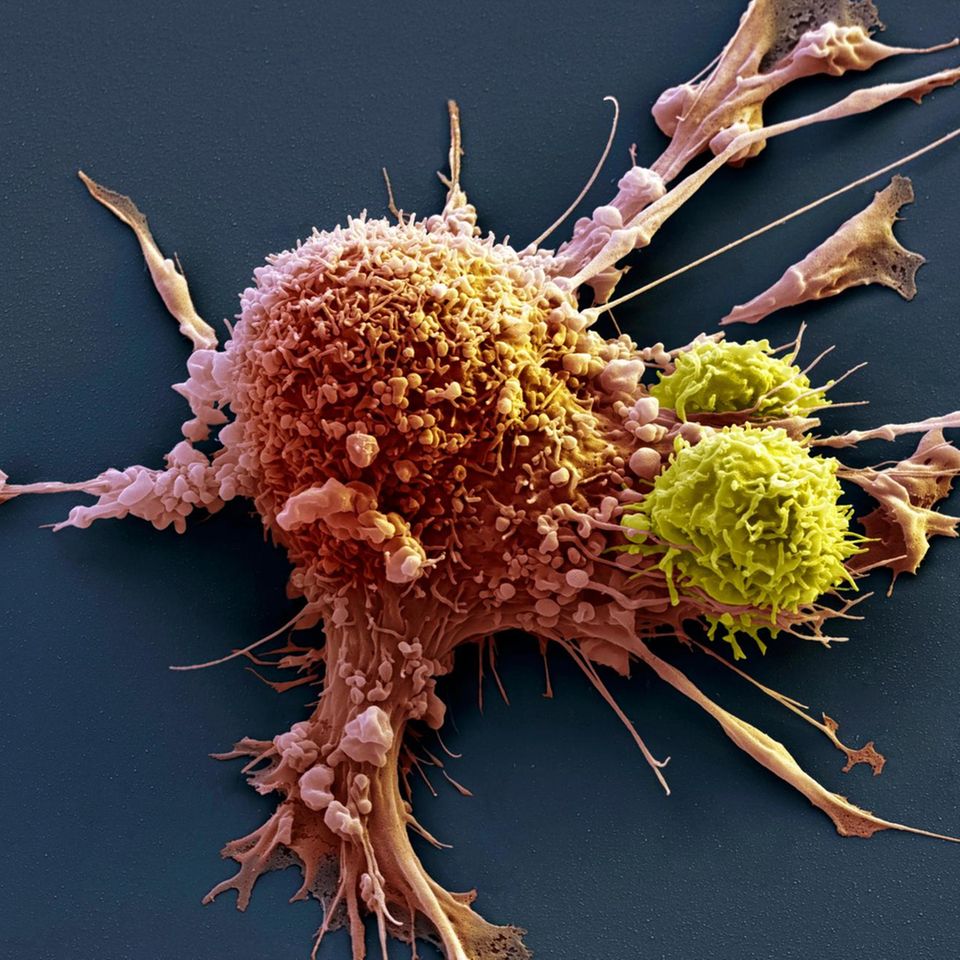
Im Fokus stehen vor allem T-Zellen. Das sind hochspezialisierte Abwehrzellen, die in der Thymus-Drüse heranreifen. T-Zellen gehören zu den weißen Blutkörperchen und zirkulieren durch unseren Körper, immer auf der Suche nach Eindringlingen oder entarteten Zellen. Im Vergleich zu Chemo- und Strahlentherapien, die auch gesundes Gewebe angreifen und massive Nebenwirkungen verursachen, agieren T-Zellen wie Scharfschützen. Im besten Fall nehmen sie einzelne Krebszellen ins Visier und zerstören sie.
Doch wie lässt sich die Arbeit der Immunzellen optimieren? Wir stellen die vier wichtigsten Ansätze vor. Professor Niels Halama ordnet jeweils ein, welche Bedeutung sie heute schon in der Krebstherapie haben – und welche Fortschritte wir in Zukunft erwarten dürfen:
1. Checkpoint-Inhibitoren lassen die Tarnung von Krebszellen auffliegen
Wie funktioniert das? Jede Körperzelle trägt auf ihrer Oberfläche Erkennungsstrukturen, wie eine Art Ausweis. Manche zeigen an, dass sie körpereigene Zellen sind, andere signalisieren patrouillierenden T-Zellen: Bitte nicht angreifen! Diese Checkpoints sollen normalerweise verhindern, dass das Immunsystem gesundes Gewebe zerstört, wie das etwa bei Autoimmunkrankheiten der Fall ist. Sie "bremsen" also die Immunzellen. Krebszellen nutzen das aus: Um von T-Zellen nicht erkannt und zerstört zu werden, fahren sie ihre Checkpoints hoch.
Checkpoint-Inhibitoren sind Medikamente, die diese Checkpoints blockieren. Dadurch werden die Krebszellen für das Immunsystem wieder sicht- und angreifbar. Häufig werden sie mit klassischen Methoden wie Chemo- oder Strahlentherapie kombiniert. 2018 erhielten James P. Allison und Tasuku Honjo den Medizinnobelpreis für ihre Entdeckungen, die zur Checkpoint-Krebstherapie führten.
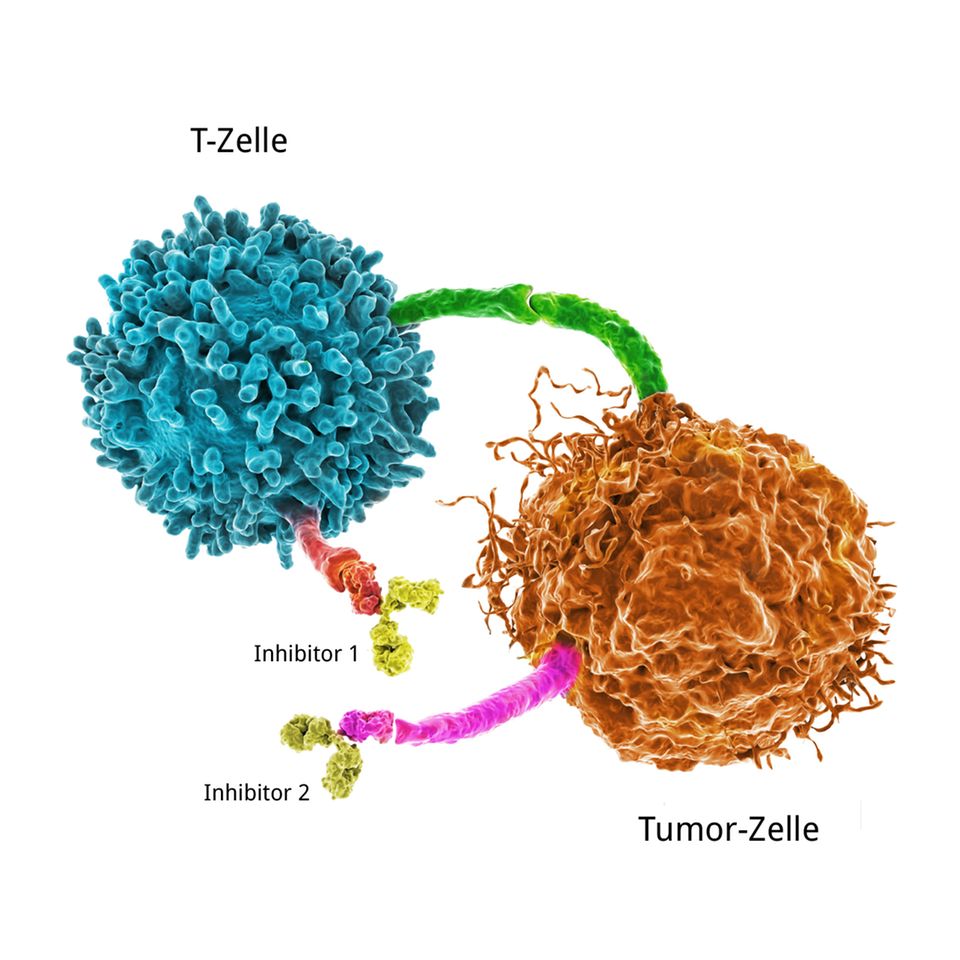
Allerdings schlagen die Checkpoint-Inhibitoren nicht bei jedem Patienten und bei jeder Krebsart an. Die Tumorzellen müssen "auffällige" Mutationen aufweisen, damit eine Immunantwort zustande kommen kann. Zum Verständnis: Mutationen können die Oberflächenstrukturen einer Zelle verändern.
Das ist in etwa so, als wären einzelne Buchstaben auf einem Ausweis mit krakeliger Handschrift geschrieben. Diese sind für das Immunsystem leicht erkennbar, und sobald der Checkpoint-Inhibitor die Bremse löst, greift es an. Hautkrebs zum Beispiel weist typischerweise viele solcher auffälligen Mutationen auf, weil unsere Haut ein Leben lang mutagenen UV-Strahlen ausgesetzt ist.
Ärztinnen und Ärzte müssen also im Einzelfall anhand der spezifischen Tumoreigenschaften abwägen, ob die Behandlung Aussicht auf Erfolg hat. Aktuell zugelassene Inhibitoren richten sich gegen die Checkpoints CTLA4, PD1 und PD-L1. Weitere sind in der Erforschung.
Haupteinsatzgebiete: Schwarzer Hautkrebs, Lungenkrebs, Nierenkrebs, Hodgkin-Lymphom, Plattenepithelkarzinome des Kopf-Hals-Bereichs, Urothelkarzinom, Merkelzellkarzinom (roter Hautkrebs), Harnblasenkrebs. Aber Achtung: Einige Tumorerkrankungen können bisher nicht damit behandelt werden, wie beispielsweise die allermeisten Darmkrebstumore, Bauchspeicheldrüsenkrebs und andere.
Nebenwirkungen: Weil die Inhibitoren das Immunsystem "scharfstellen", kann es passieren, dass auch körpereigenes Gewebe angegriffen wird. Davon kann jedes Organ oder Gewebe betroffen sein. In der Folge können Entzündungen des Darms, der Leber, der Lunge und anderer Organe entstehen. Außerdem besteht die Möglichkeit, dass Tumoren weiter mutieren und Wege finden, die Checkpoint-Inhibitoren auszutricksen.
Einschätzung von Prof. Niels Halama: Wir haben in der Immuntherapie eine "Ära der Kombinationstherapien" erreicht: Es werden aktuell Erfolge mit Kombinationen erzielt, und dort ist auch noch mehr zu erwarten. Die Checkpoint-Inhibitoren sind wichtige Basis-Therapeutika und werden derzeit oft mit anderen Therapien kombiniert, vor allem anderen Immuntherapien. Das Immunsystem besteht zudem aus zwei evolutionsbiologisch unterschiedlichen Teilen, dem adaptiven und dem angeborenen Immunsystem. Ein weiterer wichtiger Schritt wird sein, Checkpoint-Inhibitoren nicht nur (wie aktuell) für das adaptive Immunsystem verfügbar zu machen. Auch für das angeborene Immunsystem gibt es vielversprechende Ansätze.
2. Die CAR-T-Zelltherapie macht aus T-Zellen hocheffiziente Spürnasen
Wie funktioniert das? Bei der CAR-T-Zelltherapie kommt neueste Gentechnik zum Einsatz. Für Menschen, die noch nie davon gehört haben, könnte sie anmuten wie aus einem futuristischen Roman. Tatsächlich wird sie aber seit nunmehr rund einem Jahrzehnt klinisch eingesetzt. Maßgeblich entwickelt und verfeinert haben die Technik seit den 1980er-Jahren Forschende aus Japan, Israel und den USA.
Dabei werden zunächst T-Zellen aus dem Blut des Patienten entnommen. Mittels Gentechnik wird in diese Zellen der genetische Bauplan für einen speziellen, künstlich konstruierten Rezeptor eingeschleust. Dieser passt wie ein Schlüssel zum Schloss zu einem spezifischen Merkmal (Antigen) auf der Oberfläche der Tumorzellen. Sein Name: "chimärer Antigenrezeptor", daher auch die Bezeichnung CAR-T-Zelle.
Nachdem die T-Zellen den Bauplan erhalten haben, bilden sie den Rezeptor auf ihrer Oberfläche aus. Der ganze Prozess dauert mehrere Wochen. In dieser Zeit bekommt der Patient häufig eine Chemotherapie, die das körpereigene Immunsystem eindämmt, damit die CAR-T-Zellen freie Bahn haben. Anschließend werden die fertigen CAR-T-Zellen dem Patienten zurückgegeben.
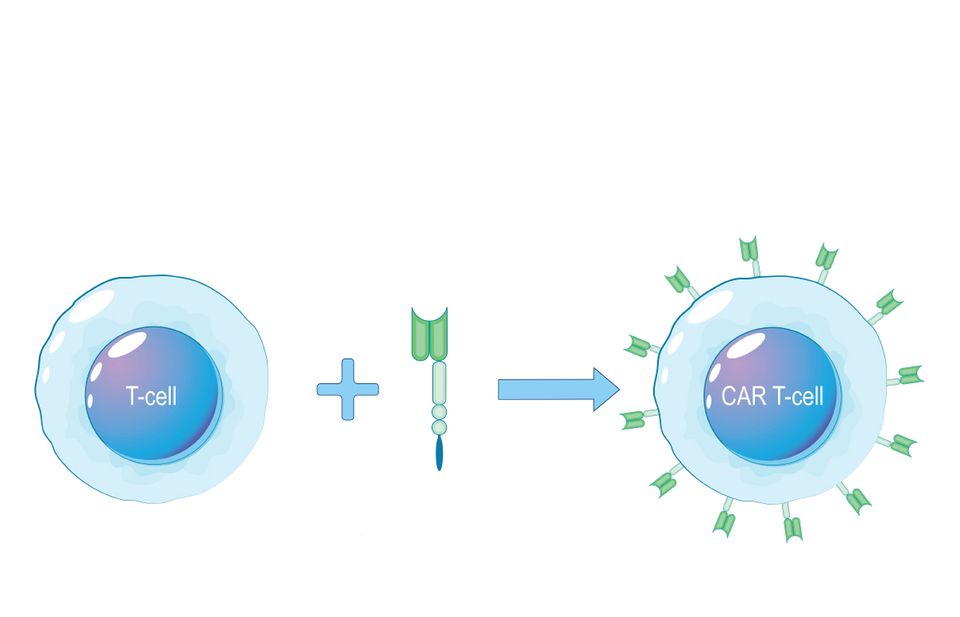
Sodann hilft der neue Rezeptor den CAR-T-Zellen, die gesuchten Tumorzellen aufzuspüren. Hat eine CAR-T-Zelle eine Tumorzelle identifiziert, leitet sie deren Zerstörung ein. Die Behandlung ist durch den hohen technischen Aufwand extrem kostspielig – aber auch so erfolgreich, dass sie als Therapie zugelassen ist. Einige der ersten behandelten Patienten sind seit rund zehn Jahren krebsfrei. Manche Fachleute sprechen gar vorsichtig von einer möglichen "Heilung".
Gleichwohl gilt es zu bedenken, dass das Verfahren nur für bestimmte Patienten in Betracht kommt und in der Regel erst angewendet wird, wenn andere Therapien versagt haben. Für manche Patienten sind mehrere Wochen Wartezeit auch schlicht zu lang. Forschende arbeiten daher aktuell daran, mithilfe gesunder Spender standardisierte CAR-T-Zellen herzustellen, um die Kosten zu senken und die Therapie schneller verfügbar zu machen.
Parallel haben Forschende die TIL-Therapie entwickelt, die derzeit in den USA zugelassen ist. Hierbei werden körpereigene T-Zellen, die den Tumor bereits infiltriert haben, entnommen, vielfach vermehrt und wieder injiziert – ohne genetische Veränderung. In Europa ist das Zulassungsverfahren jedoch 2025 im ersten Anlauf nicht abgeschlossen worden.
Haupteinsatzgebiete: Aktuell sind mehrere CAR-T-Zelltherapien für Blut- und Lymphkrebserkrankungen zugelassen. Für solide Tumoren in Geweben gibt es noch keine Behandlung. Aber erste Studien bei soliden Tumoren in Kombination mit anderen Immuntherapien sind vielversprechend.
Nebenwirkungen: Die Patienten müssen einige Zeit intensiv in einer Klinik überwacht werden, da es zu heftigen Immunreaktionen kommen kann. Schließlich werden durch die Behandlung nicht selten sehr viele Krebszellen in kurzer Zeit zerstört und massenhaft Entzündungsbotenstoffe freigesetzt ("Zytokinsturm"). Dieser Zustand kann in einigen Fällen lebensbedrohlich werden und eine Behandlung auf der Intensivstation erfordern. Andere Symptome reichen von Kopfschmerzen bis zu schwereren neurologischen Problemen. Langfristig kann sich durch die Behandlung die Zahl der Immunzellen verringern. Betroffene neigen dann vermehrt zu Infekten.
Einschätzung von Prof. Niels Halama: Die zelluläre Therapie hat in der Hämatologie, also bei Krebserkrankungen des Blutes, aufgrund der großartigen Erfolge eine sehr große Bedeutung. Wenn ein Weg gefunden wird, diese zellulären Therapien in der Breite für solide Tumorerkrankungen wie etwa Brustkrebs nutzbar zu machen, dann ist ein wichtiger Schritt getan. Allerdings stellen sich hier doch mehr Hürden in der Komplexität der Tumormikroumgebung heraus. Daher versucht man gerade durch Kombinationen und kluge Optimierung die Therapieergebnisse zu verbessern. Auch schwierig ist der Prozess des molekulargenetischen "Einbaus" von CAR-Molekülen, da es hierbei zu einem "Fehleinbau" kommen kann. Das kann in seltenen Fällen sogar zur Entstehung einer neuen Krebserkrankung bei einem Patienten führen.
3. Bispezifische Antikörper bauen Brücken zwischen Krebszellen und Immunzellen
Wie funktioniert das? Das Prinzip ist ähnlich wie bei der CAR-T-Zelltherapie. Aber anstatt die T-Zellen selbst zu verändern, werden den Patienten Antikörper (spezielle "Y"-förmige Moleküle, die gezielt an Zielstrukturen andocken) gespritzt. Man kann sich das so vorstellen, dass die Antikörper gewissermaßen zwei verschiedene Arme haben. Ein Arm greift sich eine Immunzelle, der andere Arm die Krebszelle. Ist die Verbindung hergestellt, vernichtet die Immunzelle die Krebszelle.
Allerdings müssen genügend funktionsfähige Immunzellen vorhanden sein. Bei immungeschwächten Personen oder Menschen, die schon mehrere intensive Therapien erhalten haben, ist das nicht immer der Fall. Daher sind bispezifische Antikörper nicht für alle Patienten geeignet.
Ob die Therapie im Einzelnen erfolgversprechend ist, entscheidet das Ärzteteam individuell, typischerweise im Rahmen eines interdisziplinären Tumorboards. Künftig könnte auch eine Kombination von bispezifischen Antikörpern und CAR-T-Zellen zum Einsatz kommen. Erste Versuche des Deutschen Krebsforschungszentrums (DKFZ) und des Universitätsklinikums Heidelberg (UKHD) an Zellkulturen und Mäusen verliefen vielversprechend.
Neben bispezifischen Antikörpern werden auch monoklonale Antikörper eingesetzt (deren beide "Arme" gleich sind). Sie greifen die Krebszellen direkt an. Die Namen der Wirkstoffe enden häufig auf -mab. Die bekanntesten sind HER-2-Antikörper. Sie docken an den HER-2-Rezeptor von Brustkrebszellen an und bremsen deren Wachstum. Darüber hinaus können sie bestimmte Immunzellen anlocken, die die Tumorzelle auflösen.
Solche Antikörper lassen sich auch nutzen, um beispielsweise Zellgifte oder radioaktive Wirkstoffe in die Tumorzellen zu schleusen und sie auf diese Weise von innen heraus zu bekämpfen. In diesen Fällen spricht man von Antikörper-Wirkstoff-Konjugaten.
Haupteinsatzgebiete: Bispezifische und monoklonale Antikörper werden unter anderem gegen Leukämie, Lymphome, Brust-, Lungen-, oder Darmkrebs und Melanome eingesetzt. Monoklonale Antikörper, die sich direkt gegen den Tumor richten, funktionieren nur, wenn der Tumor die Zielstruktur, an die der Antikörper andockt, auch wirklich in ausreichender Menge besitzt. Dies lässt sich anhand einer Gewebeprobe feststellen.
Nebenwirkungen: Die Nebenwirkungen sind häufig weniger ausgeprägt als bei der CAR-T-Zelltherapie. Aber auch bispezifische Antikörper können heftige Immunreaktionen auslösen. Bei monoklonalen Antikörpern können die Nebenwirkungen völlig unterschiedlich ausfallen, abhängig vom Zielgewebe. Denn sie können auch gesunde Zellen angreifen, wenn diese die Zielstruktur tragen. Bei HER-2-Antikörpern beispielsweise kann es zu Herz-Kreislauf-Problemen kommen. Auf Dauer können Tumorzellen Resistenzen gegen die Antikörper ausbilden und die Therapie, die den Krebs in Schach gehalten hat, wird wirkungslos.
Einschätzung von Prof. Niels Halama: Die "Ära der Kombinationstherapien" bedeutet auch, dass man mit diesen neuen Ansätzen gewissermaßen zwei oder mehrere Therapien in einem Molekül zusammenfassen kann. Das macht es leichter in der Anwendung und mutmaßlich auch wirkstärker. Und es kann besser mit anderen Therapieansätzen kombiniert werden. Hierzu laufen derzeit viele Studien, und die Entwicklung der Immuntherapien ist rasant. Für Patienten mit fortgeschrittener Tumorerkrankung kann es eine wichtige Option sein, an solchen Studien teilzunehmen, da hier durchaus die nächste Generation an Standardtherapien ihren Anfang hat.
4. Das große Rennen um die Entwicklung therapeutischer Krebsimpfstoffe
Wie funktioniert das? Die Vorstellung, dass man das Immunsystem gegen bestimmte Krebsarten wie gegen Masern oder Grippe impfen kann, klingt verlockend. Zum Teil funktioniert das sogar bereits. So schützt etwa die HPV-Impfung gegen Viren, die unter anderem Gebärmutterhalskrebs auslösen.
Wenn von "Krebsimpfungen" die Rede ist, sind aber meist therapeutische Krebsimpfstoffe gemeint. Diese sollen nicht vorbeugend verabreicht werden, sondern wenn jemand schon an Krebs erkrankt ist. Ziel ist, dass das Immunsystem die Erkennungsmerkmale (Antigene) des Tumors "lernt" und ihn bekämpft. Zusätzliche Checkpoint-Inhibitoren (siehe oben) stellen sicher, dass die Immunzellen auch wirklich zuschlagen. Die Impfstoffe können perspektivisch mit einigem Mehraufwand sogar auf die individuellen Tumore der Patienten maßgeschneidert werden.
Vor allem seit die DNA- und mRNA-Impfstoffe gegen COVID-19 Erfolge feierten, wetteifern verschiedene Firmen und Forschungsgruppen darum, mithilfe dieser Technik therapeutische Krebsimpfstoffe herzustellen. Es gibt aber auch andere Methoden, mit denen dieses Ziel erreicht werden kann. Aktuell sind vier Formen von Krebsimpfstoffen in der Entwicklung:
- Proteinbasierte Impfstoffe enthalten ein Eiweiß des Tumorantigens – eines Oberflächenproteins des Tumors. Anhand des Antigens werden Immunzellen trainiert, den Tumor zu erkennen und zu bekämpfen.
- DNA-Impfstoffe schleusen den Bauplan für Antigene in Körperzellen ein. Diese stellen die Antigene selbst her, die wiederum das Immunsystem trainieren.
- mRNA-Impfstoffe tragen ebenfalls den Bauplan für Antigene. Mit dem Unterschied, dass mRNA eine geringere Halbwertszeit hat und weniger ergiebig ist als DNA. Dafür gilt sie als deutlich sicherer, da nicht wie bei DNA-Impfstoffen die – wenn auch geringe – Gefahr besteht, dass sie sich dauerhaft in das Genom der Zelle integriert.
- Dendritische Zellen sind Körperzellen, die anderen Immunzellen die Antigene präsentieren und sie auf diese Weise trainieren. Wenn T-Zellen sinnbildlich die Fahnder des Körpers sind, dann sind dendritische Zellen so etwas wie Profiler, die Phantombilder erstellen, mit denen die Fahnder losziehen. Forschende haben inzwischen einige Erfahrungen damit, Patienten dendritische Zellen zu entnehmen und mit speziellen Peptiden, die den Zielstrukturen des Tumors entsprechen, zu beladen. Die dendritischen Zellen werden anschließend zurückgegeben, damit sie das Immunsystem schulen und aktivieren.
In der Praxis stecken die meisten Ansätze noch in der Erprobung. Obwohl mRNA-Vakzine medial die meiste Aufmerksamkeit erfahren und die größten Erwartungen schüren, war bislang nur die Impfung mit dendritischen Zellen in der EU zeitweise zugelassen. Allerdings gehen Fachleute davon aus, dass es nur eine Frage der Zeit ist, bis erste mRNA-Vakzine (und gegebenenfalls auch DNA-Vakzine) auf den Markt kommen. Zahlreiche klinische Studien laufen bereits.
Haupteinsatzgebiete: In Deutschland, Österreich und der Schweiz erprobt ist bislang nur die Impfung mit dendritischen Zellen. Die Zulassung ist inzwischen aber wieder erloschen. In den USA wird das Verfahren aktuell angewendet.
Nebenwirkungen: Weil sie außerhalb von Studien bislang kaum eingesetzt wurden, ist wenig über die Nebenwirkungen bekannt. Bislang wurden vor allem grippeähnliche Impfnebenwirkungen beobachtet.
Einschätzung von Prof. Niels Halama: Die Studien sind vielversprechend, und die Erwartungen sind gerade in Bezug auf schwarzen Hautkrebs hoch. Aber auch bei schwierig zu behandelnden Tumorerkrankungen wie Bauchspeicheldrüsenkrebs sind in Studien Fortschritte gemacht worden. Im Augenblick ist die Bedeutung der Vakzine besonders in einer Situation zu beobachten, in der man mit weiteren Maßnahmen den Tumor möglichst nahezu komplett entfernt. Hier ist sicher noch viel Entwicklungsbedarf. Wie genau der Einsatz in der Zukunft aussehen wird, bleibt abzuwarten.
Weitere Methoden: Zytokine, Bakterien und Viren kurbeln das Immunsystem an
Neben den vier großen Hoffnungsträgern der Immuntherapie gibt es weitere Ansätze, die ebenfalls auf Immuneffekte setzen. Zytokine etwa sind Botenstoffe, die die Aktivierung der Immunantwort steuern. Sie werden während einer Entzündung ausgeschüttet und feuern das Immunsystem gezielt an. Das kann bei der Tumorbekämpfung helfen. "Allerdings ist ihre Wirkung gegen Krebs begrenzt, und die Nebenwirkungen der Therapie können erheblich sein", schreibt der Krebsinformationsdienst.
Ein Sonderfall ist das Bakterium Bacillus Calmette Guerin, ein abgeschwächter Stamm des Tuberkulose-Erregers. Wie sich herausgestellt hat, hilft er zu verhindern, dass Harnblasenkrebs wieder zurückkehrt. Für die Behandlung wird die Harnblase wiederholt mit dem Medikament gespült und auf diese Weise das Immunsystem, das den Tumor bekämpft, aktiviert.
Nicht nur Bakterien, auch Viren werden klinisch eingesetzt. Kurioserweise befallen einige Viren bevorzugt Tumorzellen oder können dazu angeregt werden. Sie heißen onkolytische Viren. Damit infizierte Tumorzellen locken Immunzellen an, die diese zerstören und dabei im besten Fall auch verstärkt auf den Tumor aufmerksam werden. In Europa ist bislang nur ein genetisch verändertes Herpesvirus gegen fortgeschrittenen schwarzen Hautkrebs zugelassen. Weitere sind in der Erprobung.
Vorsicht vor haltlosen Versprechen von Wunderheilern
Ob eine dieser Immuntherapien in Betracht kommt, kann nur im Einzelfall entschieden werden. Erfahrene Fachleute in spezialisierten Krebszentren und interdisziplinären Teams können die Chancen und Risiken der einzelnen Therapien für die jeweiligen Patienten am besten einschätzen. Manchmal werden auch Proben aus den Tumoren der Patienten entnommen, um mithilfe von Tests festzustellen, welche Behandlung die besten Aussichten auf Erfolg hat. Die neuen Behandlungsmethoden können im Vergleich zu früher viel bewirken, aber keine Wunder, und gute Mediziner versprechen diese auch nicht.
Im Gegensatz dazu werben unseriöse "Heiler" oft damit, den Körper mit selbst entwickelten Immuntherapien oder pflanzlichen Wundermitteln gegen Krebs zu wappnen. Wie so oft bei verführerischen Versprechen steckt ein Körnchen Wahrheit darin. Schließlich ist der Körper prinzipiell selbst in der Lage Krebszellen zu bekämpfen. Aber wenn sich die Krebszellen so geschickt tarnen, dass Immunzellen sie nicht erkennen oder das Immunsystem zu stark angegriffen ist, dann helfen keine Wundermittel, sondern nur Medizin auf dem neuesten Stand der Wissenschaft.
Auch von experimentellen Behandlungen, die nicht im Rahmen klinischer Studien angeboten werden und in der Regel selbst bezahlt werden müssen, rät der Krebsinformationsdienst ab. Wer unsicher ist, kann die dortigen Fachleute um Rat fragen. Sie helfen, sich im immer dichter werdenden Dschungel der Behandlungen zu orientieren.