Für diesen Text hat die Stiftung Gesundheit Issio Ehrich mit ihrem Publizistik-Preis ausgezeichnet. Das Urteil der Jury: "eine mitfühlende, aufwändige Reportage"
Etienne Kasuku taucht sein Paddel tief in die braune Brühe des Onane. Zwei Züge links, zwei Züge rechts. Er reißt die Augen auf, um die Stelle zu entdecken, an der er seine Fischfalle ausgeworfen hat. Doch vor seinen Augen verschwimmt alles: die Wellen, die seine Piroge schlägt, das flirrende Sonnenlicht, die Schatten der Bäume auf dem Wasser. Kasuku peilt die ungefähre Richtung an. Hektisch streckt er seinen Finger aus, als er die Falle erkennt, und steuert darauf zu. Er greift ein Tau und zieht den Korb herauf. An diesem Tag kommt der Fischer zu spät: Über seinen Fang haben sich Krebse hergemacht, die jetzt im Korb übereinanderkrabbeln.
Kasuku kehrt mit leeren Händen zurück. Am Ufer des Flusses sitzt sein Vater auf einer alten Fischfalle. Er weiß, was sein Sohn gerade durchmacht. An einem Morgen vor acht Jahren wachte Germain Nduba auf und konnte nur noch hell und dunkel unterscheiden. Seine Augen sind jetzt auf den Ort gerichtet, wo er seinen Sohn vermutet. Die "Flussblindheit" hat Nduba das Augenlicht geraubt. Seither ist der einstige Fischer das, was die Menschen hier als "Mund ohne Hände" bezeichnen: Er trägt nicht mehr zum Einkommen der Familie bei, muss aber mit durchgefüttert werden. "Ich bin nutzlos", sagt Nduba.
Für "vernachlässigte Tropenkrankheiten" gibt es nur wenig Forschungsgelder
Der Onane, an dem die Familie wohnt, schlängelt sich durch den Regenwald im Norden der Demokratischen Republik Kongo. Entlang seiner Ufer leiden Tausende Menschen wie Nduba an der Flussblindheit. Fast die Hälfte seiner Landsleute lebt in einer Gegend, in der sie sich damit anstecken könnten. Die Flussblindheit gehört zu den "vernachlässigten Tropenkrankheiten", die Millionen Menschen vor allem in armen Teilen der Welt befallen, Leiden, für die es nur wenig Forschungsgelder und kaum Aufmerksamkeit gibt.
Nduba sagt, wenn sein Sohn nicht wieder gesund wird, hat die Familie keine Chance. Denn ein Kranker fordert viele Opfer. Der 37 Jahre alte Etienne Kasuku muss sich um seinen Vater kümmern und zugleich härter arbeiten, um alle durchzubringen. Wenn er zum Fischen auf den Fluss fährt, braucht der blinde, alte Mann Betreuung. Die übernimmt Marco, der zehnjährige Sohn von Etienne Kasuku, der hinter seinem Großvater steht und mit einer leeren Energy-Drink-Dose spielt. Nur wenn er mithilft, kommt die Familie halbwegs über die Runden. Vorausgesetzt, Kasuku behält sein Augenlicht.

Ein paar Kilometer flussaufwärts steigt einen Tag zuvor eine Frau die Böschung zum Onane hinab. Ihr blondes Haar ist zerzaust, ihre schwarz gerahmte Brille beschlägt. Sabine Specht, 47 Jahre alt, eine Biologin aus Deutschland, untersucht den Ort, an dem die Krankheit meist ihren Anfang nimmt. Denn in der Nähe von Flüssen sucht die Kriebelmücke, Simulium damnosum, ihre Opfer. Das Insekt, das bei der Verbreitung der Flussblindheit die entscheidende Rolle spielt. Specht widmet ihre Arbeit seit Jahren dieser Krankheit, um Menschen wie Etienne Kasuku eine Hoffnung zu geben.
Die Wissenschaftlerin rüttelt an einem Baumstamm, der ins Wasser gekippt ist. Sie dreht Äste um, die in den Fluss ragen, betrachtet die Unterseite von Blättern: An Orten wie diesen legt die Mücke ihre Eier ab. Während Specht am Ufer entlangstreift, gerät sie in einen Schwarm Mücken. Die Insekten landen auf ihrem weißen T-Shirt, ein paar auf ihrem Unterarm. Spechts Augen weiten sich vor Neugier. "Das könnten welche sein", sagt sie.
Die Tiere sind nur wenige Millimeter groß. Specht fotografiert sie mit dem Handy und zoomt sie heran. An den wulstigen, schwarzen Körpern erkennt die Forscherin: Es sind Kriebelmücken. Sie erinnern eher an Fliegen, und anders als Moskitos stechen sie auch nicht. Kriebelmücken haben ein Mundwerk aus Zangen und Sägen, mit denen sie die Haut ihrer Opfer aufreißen. An dieser Stelle entsteht, was Specht einen "Blutsee" nennt. Darin führen sie ihren Saugrüssel ein und trinken. Das ist der Moment, bei dem die Flussblindheit übertragen wird. In vielen Mücken lebt ein Parasit namens Onchocerca volvulus, ein Fadenwurm. Dessen Larve schwimmt durch den Blutsee in den Menschen, nistet sich unter dessen Haut ein, und ein fataler Prozess beginnt.
Sabine Specht trägt kein Moskitonetz und kurze Ärmel. Jeden Moment könnte eines der Insekten auch sie beißen und infizieren. Specht winkt ab. "Ich muss mir eher Sorgen machen, einen Autounfall zu haben", sagt sie und erklärt: Befinden sich nur ein paar Parasiten im menschlichen Körper, werde das Immunsystem fast immer damit fertig. Gefährlich sei es für Menschen, die den Erregern über Jahre ausgesetzt sind, wie Etienne Kasuku.

An einem schwülen Morgen im Januar kreuzen sich die Wege des Fischers und der Forscherin. Auf einer Lichtung im Regenwald, nicht weit vom Fluss entfernt, steht eine Baracke mit Wellblechdach: das Gesundheitszentrum des Dorfes Salabongo. Davor sitzen Männer und Frauen auf morschen Holzbänken und Plastikstühlen so eng beieinander, dass sich ihre schwitzenden Körper berühren. Auch Kasuku wartet hier auf seine Untersuchung.
An Armen, Beinen, unter Hemden und Kleidern seiner Sitznachbarn wölben sich Beulen. In ihnen stecken die Parasiten. Das Weibchen des Fadenwurms misst bis zu 80 Zentimeter. Meist bildet es zusammen mit einem Männchen ein Wurmknäuel unter der Haut seines Wirts. Die Knoten, Nodule genannt, können so groß wie Hühnereier werden.
Weiße Flecken übersäen die Schienbeine einiger Patienten, früher war ihre Haut dort schwarz. Die erwachsenen Würmer gebären bis zu 1000 Larven am Tag. Die begeben sich auf den Weg durch die Haut ihres Wirts. Sie versuchen an Stellen zu kommen, an denen sie eine Chance haben, zurück in eine Kriebelmücke zu gelangen – in entgegengesetzter Richtung durch den Blutsee. Nur in den Mücken können sich die Larven weiterentwickeln. Es ist ein Kreislauf, der evolutionär entstanden ist, genial und grausam zugleich. Die Bewegungen der Larven lösen Entzündungen und einen unerträglichen Juckreiz aus. Die Opfer des Parasiten kratzen sich so heftig, dass ihre Haut vernarbt und die Pigmentierung verliert.
Bei einigen der Männer und Frauen, die mit Kasuku warten, trübt ein milchiges Blau die Iris ihrer Augen. Dafür sind die Larven des Wurms verantwortlich: Gelingt es ihnen nicht, zurück in eine Kriebelmücke zu gelangen, sterben sie nach einigen Monaten. Passiert das im Auge ihres Wirts, löst das starke Immunreaktionen aus. Die zerstören dann im schlimmsten Fall Netzhaut und Sehnerv, der Mensch wird blind.
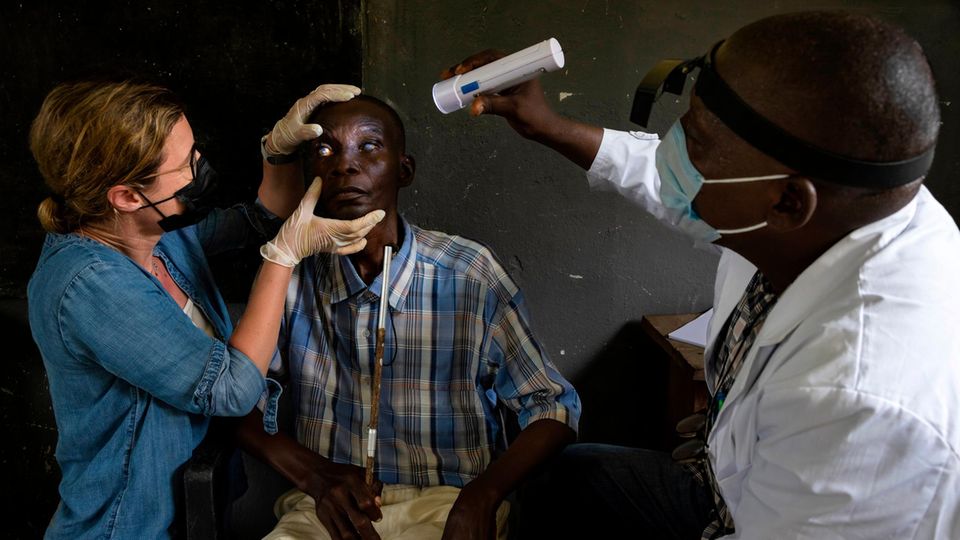
Als einer der Patienten aufgerufen wird, streckt er seine Arme aus und tastet nach einer helfenden Hand. Meist begleiten Angehörige die Kranken ins Gesundheitszentrum. Etienne Kasuku findet den Weg noch allein. In einem halbdunklen Untersuchungsraum empfängt ihn Sabine Specht.
Sie hebt Kasukus Hemd an und tastet ihn ab. Drei Knoten findet die Forscherin. Sie fühlen sich an, als hätte ihm jemand Steine unter die Haut geschoben. Specht krempelt seine Hosenbeine hoch. Die Haut hat an den Schienbeinen feine Falten bekommen, ihre Elastizität verloren, ein typisches Krankheitszeichen. Dann greift sie zu einer Taschenlampe und leuchtet dem Fischer in die Augen. Sie sind trübe. "Sieht nach Oncho aus", sagt Specht.
Mit "Oncho" meint die Wissenschaftlerin Onchozerkose, die Flussblindheit. Kasuku befindet sich in einem frühen Stadium. Für den Fischer ist es vielleicht noch nicht zu spät. Ein Mitarbeiter des Gesundheitszentrums drückt Kasuku entzündungshemmende Tabletten und Augentropfen in die Hand. Sie lindern den Juckreiz. Vorm Erblinden schützen sie nicht. Zumindest in diesem Augenblick kann Specht nicht mehr für Kasuku tun.
Zwar gibt es bereits ein starkes Medikament gegen die Flussblindheit, Kasuku hat es auch schon mehrmals bekommen. Doch das Mittel Mectizan muss über viele Jahre eingenommen werden, um zu wirken. Derzeit aber funktioniert die Verteilung in der Demokratischen Republik Kongo nicht, die medizinische Infrastruktur ist prekär. Zudem kann das Medikament in diesem Teil der Welt tödliche Nebenwirkungen auslösen, wenn eine andere Parasitenart dazukommt, die in diesem Teil der Welt nicht selten ist.

Deshalb reist Specht nun durch das Land. Sie will die Entwicklung eines neuen Wirkstoffs vorantreiben. Das Mittel soll schneller wirken und verträglicher sein als Mectizan. Eine Herausforderung. Denn die Forscherin ringt nicht nur mit den Tücken der Natur, sie ringt auch mit den Mechanismen eines globalen Gesundheitswesens, das den Gesetzen des Marktes folgt.
Während Specht einen Erkrankten nach dem anderen untersucht, setzt sich Kasuku in den Schatten eines Baumes. Seine Basketballstiefel sind abgewetzt. Statt eines Gürtels hat er sich einen Streifen Schilf um die Hüfte gebunden, um seine viel zu weite Hose zu halten. "Früher bin ich an den großen Tshopo-Fluss gegangen, um zu fischen", erzählt er. In guten Zeiten habe er 10.000 kongolesische Francs im Monat verdient, rund fünf Euro. "Aber am Tshopo finde ich mich nicht mehr zurecht. Ich hab mein Selbstvertrauen verloren", sagt er. Nun ist sein Revier eine Windung des Onane, die er gut kennt, in der es aber weniger Fische gibt.
Kasuku und die meisten seiner Landsleute können sich Arzneimittel kaum leisten – drei von vier leben unter der internationalen Armutsgrenze; Krankenversicherungen oder Sozialhilfe gibt es nicht.
Bei den vernachlässigten tropischen Krankheiten wie der Flussblindheit geht es keineswegs um ein paar Wenige, die unter einer seltenen Plage leiden. Weltweit sind, Schätzungen zufolge, 20 Millionen Menschen allein von dem Erreger Onchocerca volvulus befallen. Die Krankheit ist die zweithäufigste infektiöse Ursache für Blindheit. Doch Hilfe gibt es kaum. Zu wenig lukrativ, als dass Pharmafirmen ihr Geld in die Erforschung stecken würden. Im Gegenteil. Specht sagt: "Man kann nicht von einem Unternehmen erwarten, dass es in ein Produkt investiert, bei dem es die Entwicklungskosten nicht wieder reinholen kann".
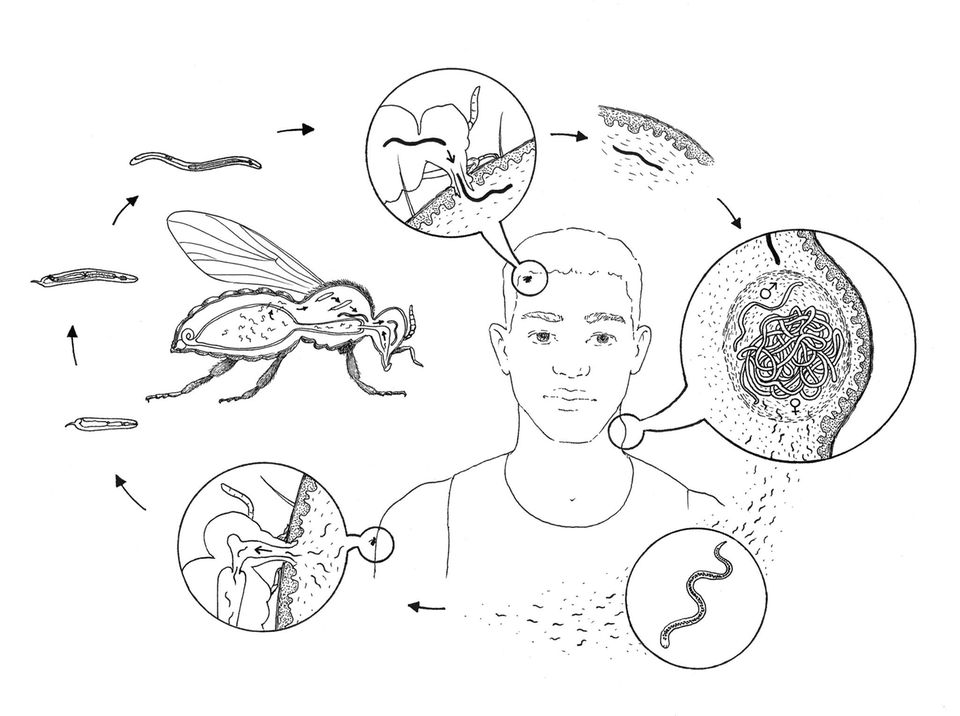
Am Anfang (oben, dann im Uhrzeigersinn) steht der Biss einer Kriebelmücke. Trinkt sie das Blut eines Menschen, können Wurmlarven in dessen Körper geraten. Sie dringen in das Gewebe unter der Haut ein und wachsen zu langen Weibchen und kurzen Männchen heran: auf der Haut zeigen sich Knoten. Die Fadenwürmer pflanzen sich fort, produzieren Larven, in diesem frühen Stadium Mikrofilarien genannt. Diese wandern in Haut und Bindegewebe. Um sich weiterentwickeln zu können, müssen sie wieder in eine Mücke gelangen, die sie beim Trinken aufnimmt. Sie durchlaufen Larvenstadien und gelangen zum Kopf des Insekts. Bei einer erneuten Blutmahlzeit können sie den nächsten Menschen befallen. Mikrofilarien, die im Menschen bleiben, wandern durch den Körper. Sterben sie im Auge, löst das Immunreaktionen aus: Netzhaut und Sehnerv werden zerstört, der Mensch erblindet
Specht sucht daher Wege, die Entwicklung ihres Medikaments so günstig wie nur möglich zu halten, sagt sie. Ihre Forschung bezahlt derzeit zu einem Großteil die Bill-and-Melinda-Gates-Stiftung. Der amerikanische Arzneimittelhersteller AbbVie unterstützt sie ebenfalls. Bis zum Jahr 2024 sind noch Gelder zugesagt. Das aber, sagt sie, reiche nicht. Sie wirbt weiter um Förderer, leistet Überzeugungsarbeit, will der Welt begreifbar machen, um was für Schicksale es hier geht. Dass die Finanzierung mitten in der Entwicklung des Medikaments wegbricht, hängt wie ein Damoklesschwert über ihrem Projekt.
Specht steckt mitten in den klinischen Studien für das neue Mittel. Die Verträglichkeit des Präparats hat sie bereits an gesunden Menschen in Europa und den USA getestet: Phase I. Später auf dieser Forschungsreise wird sie untersuchen, wie Erkrankte in der Demokratischen Republik Kongo darauf reagieren: Phase II, in der sich zeigt, ob das Medikament wirkt. Dieser Teil der Studie findet im Süden des Landes statt, weil dort die medizinische Versorgung für die Probanden besser ist. Jetzt bereitet sie im Norden des Landes schon Phase III vor: den großflächigen Einsatz in besonders schwer betroffenen, unzugänglichen Gebieten. Dafür verschafft sie sich einen Eindruck vom Ausmaß der Krankheit und der Infrastruktur vor Ort. Ihre Basis ist die Millionenstadt Kisangani. Von dort besucht sie entlegene Gesundheitszentren wie das in Salabongo.

Ein paar Tage nach dem Treffen mit dem Fischer sitzt Specht auf der Rückbank eines Jeeps. Ihr Kopf wackelt bei jedem Schlagloch hin und her. Specht ist seit fast einer Woche im Norden der Demokratischen Republik Kongo unterwegs. "Du musst den Spuren der Krankheit folgen", sagt sie.
Der Jeep verlässt Kisangani nach Norden in Richtung der Stadt Bengamisa . Die Straße führt an einem Staudamm vorbei. Mehrere Schotten haben Lecks, aus denen Wasser schießt. In den drei Monaten vor Spechts Ankunft gab es in Kisangani keinen Strom. Und je weiter sich der Wagen von der Großstadt entfernt, desto schlechter wird die Infrastruktur. Ein Kontrast zu Spechts gewohnter Welt.
Sie kam in Stade an der Elbe zur Welt. Plattes Land, kühle Luft und ein bis in die Vorgärten durchorganisiertes Gemeinwesen. Specht wuchs in einer Arbeiterfamilie auf. Ihr Vater war Chemiemeister, ihre Mutter Hausfrau. Eine von Spechts Kindheitserinnerungen: Ihre Mutter tischte Makrele auf. Statt das Tier zu essen, fing das Mädchen an, die Augen aus dem Fisch zu sezieren. Specht gefiel es, die Dinge von Nahem zu betrachten, sagt sie. Eine Vorliebe, die sie in ihrem späteren Leben als Forscherin voranbringen sollte.
In der Schule sei sie keine Überfliegerin gewesen. Einen Leitsatz ihres Vaters zitiert und beherzigt Specht bis heute: "Wenn du etwas anfängst, musst du es auch zu Ende bringen."
"In Deutschland würde kein Mensch seine Kinder mit diesen Würmern im Körper herumlaufen lassen"
Sie studierte Biologie und spezialisierte sich auf Zoologie, Biochemie und Hydrologie. Specht sagt: "Klar strukturierte und gut dokumentierte Antworten zu finden, das entspricht voll meinem Mindset." Das genaue Hinsehen hat sie perfektioniert. "In einem Detail kann man ein ganzes Universum entdecken", sagt sie. Die Parasiten, die sie erforscht, nennt Specht "bloody beautiful": verdammt schön.
Sie widmet sich dem Onchocerca volvulus bereits fast 20 Jahre, wurde eine der führenden Wissenschaftler*innen auf dem Gebiet. Irgendwann stieß sie an die Grenzen der Hochschulforschung. Dort sei es kaum möglich, so Specht, ein Medikament von der Entdeckung einer wirksamen Substanz bis zur Marktreife zu bringen. 2017 nahm sie in Genf eine Stelle an bei der gemeinnützigen Organisation DNDi (Drugs for Neglected Diseases Initiative), die sich der Behandlung vernachlässigter Tropenkrankheiten verschrieben hat. "In Deutschland würde kein Mensch seine Kinder mit diesen Würmern im Körper herumlaufen lassen. Und wenn es hier passiert, nehmen wir das einfach so hin?" Das ist unfair, sagt Specht. "Wir wollen die Welt ein bisschen gerechter machen".
Freie Zeit hat Specht auf ihren Forschungsreisen so gut wie nie. Selbst auf der Rückbank des Jeeps studiert sie Tabellen in ihrem Notebook. Der Wagen rauscht an Wäldern vorbei, die irgendwann nur noch als grünes Flirren erscheinen. Am Straßenrand bilden Jungen und Mädchen in blau-weißen Uniformen eine Schlange. Sie tragen Bambusrohre auf ihren Schultern, vermutlich Material, um ihre Schule aufzubauen. Specht sieht ihnen nach. Ihre eigene Familienplanung, sagt sie, habe sie der Arbeit untergeordnet. "Die Zeit ist so schnell verstrichen. Irgendwann war es für Kinder zu spät."
Nach drei Stunden auf der Straße steigt Specht vom Jeep in eine Piroge um, die den Fluss Lindi überwindet. Die Fährmänner paddeln nah am Ufer flussaufwärts, wo die Strömung nicht so stark ist. Dann queren sie und landen direkt am Ziel: einem Dorf im Gesundheitsbezirk Bengamisa. Menschen mit Flussblindheit werden hier in der Dorfschule untersucht. Specht ist kaum angekommen, da sagt sie: "Ich hab noch nie in meinem Leben so viel Leopardenhaut gesehen." So werden die weißgekratzten Schienbeine der Männer und Frauen genannt. In diesem abgelegenen Dorf ist die Lage noch prekärer als in Salabongo.

In der Region im Norden mit fast vier Millionen Einwohnern sind 20 von 23 Gesundheitsbezirken endemisch. Womöglich mehr. Die Statistiken der Behörden stammen vom Beginn des Jahrtausends. Die medizinische Infrastruktur ist verheerend, klinische Studien in Phase I oder II wären deshalb gefährlich: "Wir können nichts machen, was eine Notfallversorgung erfordert", sagt Specht. Nebenwirkungen könnten tödlich enden, weil kein Krankenhaus erreichbar ist.
Für Phase III allerdings ist die Gegend umso interessanter. Hier lasse sich das Mittel unter realistischen Bedingungen an vielen Probanden erproben. Das aber ist erst möglich, "wenn das Medikament in der Entwicklung weit fortgeschritten ist", sagt Specht. "Wir brauchen einen langen Atem."
Die Forscherin spricht immer wieder von "Ausdauer". Die Corona-Pandemie habe gezeigt, wozu die Pharmaindustrie imstande sei. Binnen Monaten gab es gleich mehrere Impfstoffe. Geht es um vernachlässigte tropische Krankheiten, sei der Fortschritt zäh. "Die größte Herausforderung bei der Medikamentenentwicklung ist es, aus Tausenden potenzieller Substanzen einen Wirkstoff herauszusuchen, der tatsächlich den gewünschten Effekt hat", erklärt Specht. Die großen Pharmaunternehmen hätten gewaltige Datenbanken, aus denen sie dabei schöpfen können, und sie hätten das Geld, um diese ausgiebig in Tierversuchen zu testen. "Normalerweise kostet die Entwicklung eines Medikaments rund eine Milliarde Euro", sagt Specht. "Wir müssen wohl mit ungefähr 100 Millionen Euro auskommen".
Weniger Geld bedeutet bei der Arzneimittelherstellung vor allem eines: weniger Tempo. Specht hofft, das neue Medikament spätestens in zehn Jahren registrieren zu lassen. Wenn es denn funktioniert. Dann könne es nochmals so lange dauern, bis es wirklich bei den Patienten ankommt, sagt sie. Specht stellt sich darauf ein, ihre gesamte Karriere dem Kampf gegen die Flussblindheit zu widmen. "Ein Medikament bis zur Marktreife zu bringen, das wäre wohl so etwas wie ein Lebensziel."

Dem Fischer Etienne Kasuku aber läuft die Zeit davon. Nach dem Morgen am Onane stapft er in Richtung Babagulu II, der Siedlung, in der er wohnt. Dorthin führt eine Schneise, die mit der Machete in den Regenwald geschlagen wurde. Marco folgt ihm mit dem Großvater an der Hand. Kasuku versucht, im hüfthohen Dickicht nirgends hängen zu bleiben, hebt seine Arme, als würde er ein Kind tragen, tastet sich über einen Stamm, der im Weg liegt. Kasuku hatte einst mit seiner Frau geplant, ein neues Leben in Kisangani anzufangen, einen Laden aufzumachen. Doch dann ließ die Sehkraft nach. Seine Frau verließ ihn vor ein paar Monaten und nahm zwei ihrer gemeinsamen Kinder mit.
Die Lage von Menschen wie Kasuku erschien nicht immer so düster. Lange vor Spechts Studien gab es Pläne, die Onchozerkose auszurotten. Nur sind diese fast in Vergessenheit geraten.
In den 1930er-Jahren erkannten Forscher einen Zusammenhang zwischen dem Parasitenbefall und hohen Raten von Erblindeten. In einigen Gegenden des damaligen Belgisch-Kongo verlor jeder fünfte Mensch, den der Fadenwurm befiel, sein Augenlicht. Jeder zweite war sehbehindert. Auch zahllose Menschen in Ghana, Südamerika und im Nahen Osten waren betroffen. Die Krankheit führte dazu, dass fruchtbare Landstriche entvölkert wurden. Junge Menschen sahen, wie ihre Eltern erblindeten, und flohen.
Nach dem Zweiten Weltkrieg taten sich Weltbank, Weltgesundheitsorganisation (WHO) und andere Agenturen der Vereinten Nationen zusammen, um die Flussblindheit zu bekämpfen. Zunächst setzte die Gemeinschaft auf den Einsatz von Pestiziden im Westen des afrikanischen Kontinents. Eine Flotte aus Hubschraubern und Flugzeugen griff die Brutstätten der Kriebelmücke an. Ende der 1970er-Jahre wurden Flussbetten auf einer Länge von 18.000 Kilometern pro Woche behandelt.
Mitte der 1970er entdeckten Forscher aus Japan und den USA einen Mikroorganismus in der Bodenprobe Nummer OS3153 von einem Golfplatz im japanischen Ito. Das daraus gewonnene Isolat erwies sich als hochwirksames Wurmbehandlungsmittel, 100-mal stärker als alle anderen zu der Zeit verfügbaren. Schnell zeigte sich, dass es auch bei der Flussblindheit hilft.
Weltweit gibt es Millionen Infizierte, 99 Prozent von ihnen Afrikaner
Der amerikanische Pharmahersteller Merck Sharp & Dohme (MSD) brachte den Wirkstoff für Menschen als Mectizan auf den Markt und stellte das Medikament für Flussblinde kostenlos zur Verfügung. In Westafrika gelang es dank der Kombination aus Pestizideinsatz und Mectizan, die Krankheit unter Kontrolle zu bringen. Um dies auch auf dem Rest des Kontinents zu schaffen, gründete die WHO 1995 das Programm für die Kontrolle der Onchozerkose. Allein im letzten Jahr des Programms, 2015, wurden mehr als 100 Millionen Menschen behandelt. Jenen, die das Augenlicht noch nicht verloren hatten, blieb das Schicksal erspart.
Für die Entdeckung des Wirkstoffs bekamen Satoshi Ōmura und Bill Campbell 2015 den Nobelpreis. Doch als es so aussah, als sei das Problem so gut wie gelöst, schwand die Aufmerksamkeit – obwohl es weltweit Millionen Infizierte gibt, 99 Prozent von ihnen Afrikaner. Die Welt nahm kaum Kenntnis davon, dass weder der Pestizideinsatz noch das Wundermittel Mectizan in Regionen wie dem kongolesischen Regenwald wirkten.
Auf halben Weg zwischen Onane-Fluss und Babagulu II stolpert Kasuku, und seine Schuhsohle reißt. In diesem Dickicht wird schnell deutlich, warum die früheren Bemühungen, die Flussblindheit zu bekämpfen, hier wenig Aussicht auf Erfolg hatten. Der Regenwald ist so dicht, dass Pestizide die Brutstätten der Kriebelmücke kaum erreichen könnten, Bäume und Sträucher würden das Gift abfangen. Auch Mectizan kam in dieser Gegend kaum an.
Babagulu II besteht aus ein paar Lehmhütten am Rande einer Schotterstraße. Es gibt keinen Strom, kein Frischwasser. Als Toilette dienen zwei Balken über einem Loch am Waldrand. In der Demokratischen Republik Kongo begann die Ausgabe von Mectizan Anfang des Jahrtausends. Bis 2020 wussten weder Kasuku noch sein Vater, dass es seither einmal im Jahr kostenlos verteilt wird. Für Nduba kommt jede Hilfe zu spät. Doch auch für Kasuku ist Mectizan wohl nicht die Rettung.
Theoretisch ließe sich sein Erblinden mit Mectizan stoppen. Doch das Mittel hat Schwächen. Es macht die Würmer für einige Monate unfruchtbar und tötet ihre Larven, die sich bereits auf die Reise durch den menschlichen Körper begeben haben. Es tötet aber nicht die erwachsenen Parasiten. Sobald die Mectizan-Wirkung nachlässt, produzieren sie neue Larven. Kasuku müsste also so lange Mectizan nehmen, bis die adulten Würmer in seinem Körper eines natürlichen Todes sterben. Mindestens einmal im Jahr, etwa 15 Jahre lang. Das ist in Gegenden mit schlechter medizinischer Versorgung unrealistisch. Außerdem reagiert Mectizan heftig mit einem anderen Parasiten (Loa loa), der viele Menschen im Land befällt. Wird ein Patient trotz Co-Infektion behandelt, kann er an den Nebenwirkungen sterben.
Anfang des Jahres bekam der Kampf gegen die Flussblindheit einen weiteren Schlag. Die kostenlose Verteilung von Mectizan, vorgesehen für den Januar, blieb aus. Der Hersteller Merck Sharp & Dohme stellt das Medikament auch 2022 gratis zur Verfügung, doch das Geld für die Verteilung der Pillen fehlte. Großbritannien, bisher einer der großzügigsten Spender im Kampf gegen vernachlässigte Tropenkrankheiten, kürzte nach dem Brexit seine Ausgaben. Die Wohltätigkeitsorganisation Sightsavers schätzt deshalb, dass in diesem Halbjahr mehr als 70 Millionen Menschen, die von vernachlässigten tropischen Krankheiten bedroht sind, keine Medikamente bekommen. Derzeit ist unklar, wer die Lücke füllt – und damit auch, ob Etienne Kasuku das Mectizan bekommen wird.
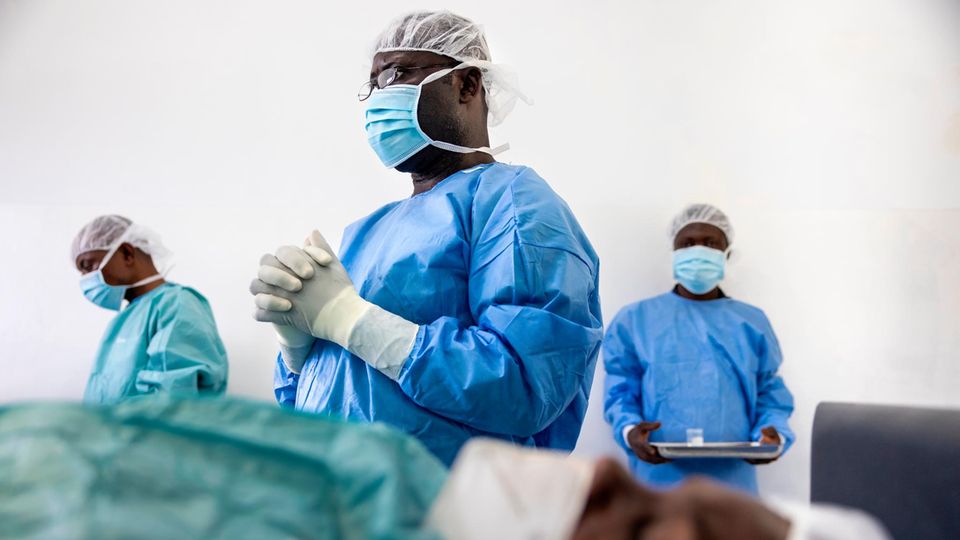
Ein paar Tage nach ihrer Expedition im Norden kommt Sabine Specht im Krankenhaus von Masi-Manimba an, der nächsten Station ihrer Forschungsreise, rund 1000 Kilometer südwestlich von Kisangani. In dieser Region ist die medizinische Infrastruktur besser. Hier läuft Phase II der klinischen Studien: Erkrankte bekommen das neue Mittel, in das Specht ihre Hoffnung setzt – TylAMac. Hier soll sich zeigen, ob es wirkt.
Eine Operationsleuchte wirft grelles Licht auf einen Operationstisch. Darauf liegt eine Frau. Ein türkisgrünes Tuch bedeckt ihren Körper und lässt nur eine Stelle an der Hüfte frei. Dort zeigt sich eine jener Beulen, die so typisch sind für die Flussblindheit. Specht steht ein paar Meter neben der Patientin.
Die Frau auf dem Operationstisch hat vor einigen Monaten TylAMac genommen. Es soll, nach wenigen Einnahmen, einen langsamen Tod der erwachsenen Würmer einleiten.
Specht ist nicht allein für die Entdeckung verantwortlich. Bereits in den 1970er-Jahren fand der Forscher Bill Kozak im Inneren der Fadenwürmer Bakterien der Gattung Wolbachia. Sie leben in einem symbiotischen Verhältnis mit dem Wurm. Einer von Spechts wissenschaftlichen Ziehvätern, Achim Hörauf, stellte fest, dass der Wurm unfruchtbar wird, wenn die Bakterien fehlen. Er kann dann über Jahre keine Larven mehr gebären. Specht war federführend an Studien beteiligt, die nachweisen, dass der erwachsene Wurm ohne die Wolbachien sogar eingeht.
Schon während ihrer Zeit an der Universität suchte Specht mit Kollegen nach Mitteln, die die Wolbachien töten. Weil kaum Geld da war, konzentrierte sie sich auf Präparate, die bereits auf dem Markt waren – Mittel für Mensch oder Tier. Ein Trick, um die Forschung zu vernachlässigten tropischen Krankheiten zu beschleunigen.
Für Hochinzidenzgebiete wie Salabongo erwies sich ein Medikament als vielversprechend, das für die Linderung von Infektionen bei Rindern und Schweinen zugelassen ist, es wird vom amerikanischen Pharmakonzern AbbVie hergestellt. In einer an den Menschen angepassten Form ist es nun genau dieses Produkt, das als TylAMac bei der Patientin auf dem Operationstisch gewirkt haben könnte.
Eine Krankheit auszurotten gleicht einem Marathonlauf
Im Operationssaal steht Dr. Felix Akwaso Massa, der mit Specht an den klinischen Studien arbeitet. Er setzt das Skalpell an und macht einen flachen Schnitt über der Beule. In die Wunde schiebt er eine Schere, die nicht schneidet, wenn er sie schließt, sondern wenn er sie öffnet. Nach und nach legt er den Knoten unter der Haut frei. Irgendwo darin haust ein erwachsener Onchocerca volvulus.
Die Knoten, die Felix Akwaso Massa entnimmt, schickt sein Team in ein Labor nach Bonn. Stellt sich heraus, dass der Wurm schon lange vor der Operation tot war, wirkt das neue Medikament höchstwahrscheinlich. Lebt der Wurm noch, funktioniert TylAMac wohl nicht. Mit verlässlichen Ergebnissen rechnet Specht in einigen Monaten. Massa und sein Team machen solche Nodulektomien bei mehr als 100 Patienten, die mit TylAMac oder Placebos behandelt wurden.
Neben TylAMac treibt Specht die Entwicklung von zwei weiteren Substanzen für den Kampf gegen die Flussblindheit voran, Emodepsid und Oxfendazol. Die Chancen sind groß, dass zumindest eines der Mittel wirkt.
Wenn Specht durch Masi-Manimba eilt, um den Fortschritt ihrer Studie zu überprüfen, hält sie oft inne, um Labortechnikern zu erklären, wie sie die Knoten am besten lagern können. Oder sie erläutert, wie es gelingt, Kranken möglichst schmerzfrei Hautproben zu entnehmen. Am Tag der Nodulektomien ermahnt Specht gar einen Augenarzt, der Erdnussschalen auf den Boden eines Büros krümelt. Unter ihren Kollegen hat die Deutsche zwei Spitznamen: "Mama Sabine" und "Elektroschock".
Specht vergleicht den Versuch, eine Krankheit auszurotten mit einem Marathonlauf. Die letzten Kilometer seien die härtesten. Sie sagt: "Ich bin jetzt nicht der Typ, der mit 64 unbedingt in Rente gehen muss." Derzeit stehen die Chancen gut, dass sie ein Medikament gegen die Flussblindheit finden wird. Für den Fischer Etienne Kasuku aber dürfte es zu spät kommen. Es sei denn, ihm gelingt es irgendwie, die Zeit mit Mectizan zu überbrücken.
In Kasukus Lehmhaus in Babagulu II erzählt jeder Raum eine kleine Geschichte. Opa Ndubas Zimmer ist ein dunkler Verschlag. Hier findet sich nur zurecht, wer die Welt ertastet. In Kasukus Zimmer herrscht Chaos. Auf dem Boden liegen staubige Flaschen, zerfetzte Schuhe und Latschen, alte Batterien. Doch noch hat Kasuku die Kontrolle nicht verloren. Was wertvoll für ihn ist, eine Tube Zahnpasta und zwei Riegel mit Paracetamol-Tabletten, lagert er gut sichtbar auf seinem Moskitonetz. Marcos Zimmer dagegen ist fast steril. Es gibt nur eine Holzpritsche. Daneben liegt eine kleine grüne Taschenlampe. Auf die Frage, was er einmal werden möchte, antwortet Marco. "Schneider. Kein Fischer."